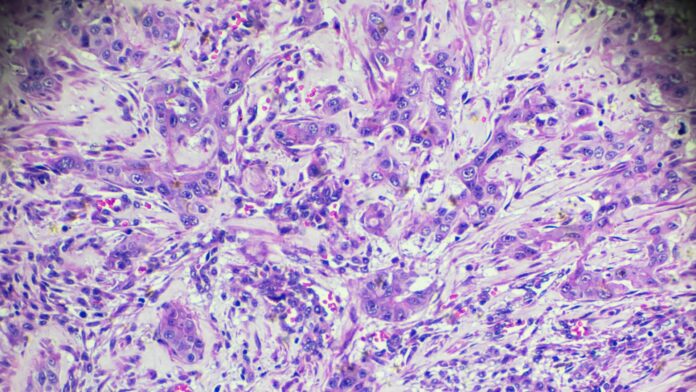
O Carcinoma Hepatocelular é o tumor maligno primário mais comum do fígado e a terceira principal causa de morte por câncer no mundo. Diferente de outras neoplasias, geralmente surge em um “solo fértil”: o fígado cirrótico. O manejo deste paciente exige um equilíbrio delicado entre tratar o câncer epreservar a função hepática restante.
Fisiopatologia e Fatores de Risco
A regra prática é clara: 90% dos casos de CHC ocorrem em pacientes cirróticos. A inflamação crônica e a regeneração nodular incessante criam o ambiente propício para mutações.
As principais etiologias incluem:
- Cirrose (Qualquer causa): O principal fator de risco isolado.
- Hepatite B (HBV): Possui um mecanismo de carcinogênese único. O vírus B integra seu DNA ao genoma do hepatócito, podendo causar CHC mesmo na ausência de cirrose.
- NASH (Esteatohepatite Não Alcoólica): Com a epidemia de obesidade, tem se tornado uma causa emergente e preocupante, muitas vezes diagnosticada tardiamente.
Rastreio (Screening)
O objetivo é detectar a lesão em estágio curativo (assintomático).
- Público-Alvo: Todo paciente cirrótico (Child A e B; Child C apenas se estiver em lista de transplante) e portadores de Hepatite B crônica (especialmente asiáticos >40 anos e africanos).
- Método: Ultrassonografia (USG) de Abdome a cada 6 meses.
- Papel da Alfa-fetoproteína (AFP): Embora controverso internacionalmente, no Brasil é utilizado como adjuvante.
- AFP > 400 ng/ml: Altamente sugestivo de CHC em pacientes de risco.
- AFP > 1.000 ng/ml: Sinal de péssimo prognóstico, sugerindo invasão vascular ou micro-metástases (pode contraindicar o transplante).
Diagnóstico não invasivo
O CHC é uma das poucas neoplasias que pode ser diagnosticada sem biópsia, desde que o paciente seja de risco (cirrótico/HBV) e apresente o padrão vascular típico em exame dinâmico (TC ou Ressonância Magnética trifásica).
O Padrão Típico (“Washout”):
O fígado recebe sangue majoritariamente da veia porta (75%), mas o CHC, como todo tumor, cria neovasos arteriais.
- Fase Arterial: A lesão brilha intensamente (Hipervascularização), pois recebe sangue da artéria hepática enquanto o resto do fígado ainda está “esperando” o sangue portal.
- Fase Venosa/Portal: O contraste sai rapidamente do tumor (Washout ou lavagem), tornando a lesão hipodensa em relação ao fígado, que agora está brilhando com o contraste portal.
- Pseudocápsula: Realce periférico na fase tardia.
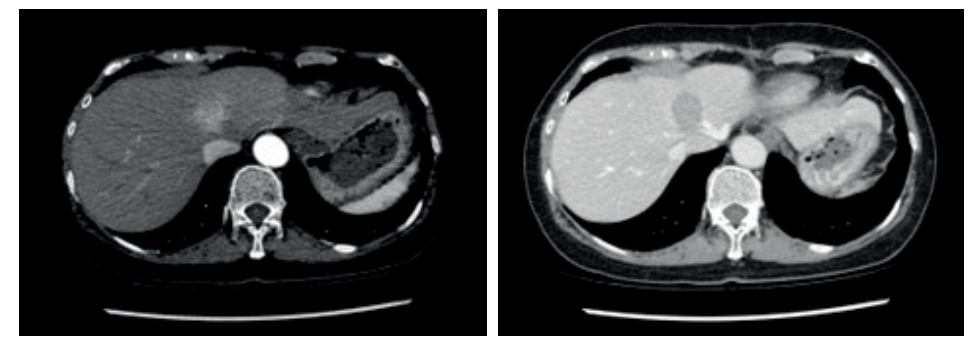
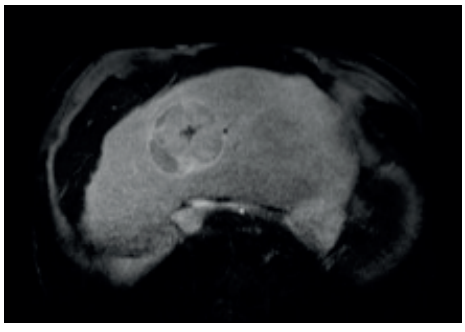
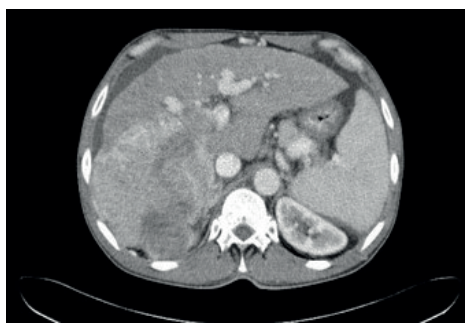
Classificação LI-RADS (Liver Imaging Reporting and Data System)
- LI-RADS 3: Probabilidade intermediária.
- LI-RADS 4: Provável CHC.
- LI-RADS 5: Definitivamente CHC. (Trata-se sem biópsia).
Estadiamento e Conduta (Sistema BCLC)
O sistema de Barcelona (BCLC) é o padrão-ouro pois considera: Tamanho do Tumor + Função Hepática (Child) + Performance Status (ECOG).
Estágio 0 (Muito Precoce) e A (Precoce) – Intenção Curativa
Pacientes com nódulo único ou até 3 nódulos < 3cm, com função preservada. Aqui temos o grande dilema: Ressecção ou Transplante?
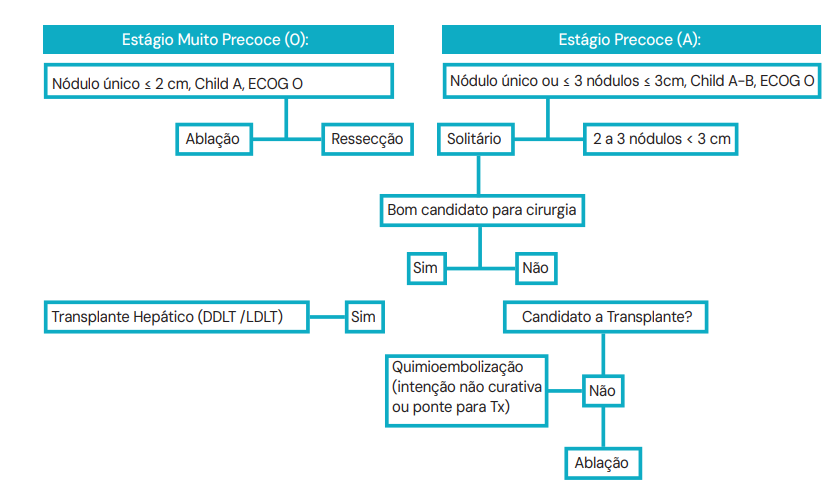
A. Ressecção (Hepatectomia):
Ideal para nódulo único em paciente com função hepática excelente.
- Critérios de Segurança (obrigatórios para não matar o paciente de insuficiência hepática):
- Ausência de Hipertensão Portal (Sem varizes esofágicas, plaquetas > 100.000).
- Bilirrubinas normais.
- Remanescente hepático adequado.
B. Transplante Hepático:
É a melhor opção oncológica, pois remove o tumor e a doença de base (cirrose).
- Critérios de Milão: Para entrar na fila, o paciente deve ter:
- 1 nódulo $\le$ 5 cm; OU
- Até 3 nódulos, nenhum maior que 3 cm.
- Ausência de invasão vascular ou metástases.
- Critério de Desempate (MELD): Pacientes com CHC dentro de Milão recebem pontos extras no MELD (iniciam com 20, sobem para 24 em 3 meses, depois 29) para “furar a fila”, devido ao risco de progressão tumoral.
C. Ablação por Radiofrequência:
Opção curativa para nódulos pequenos (< 3cm) em pacientes que não toleram cirurgia.
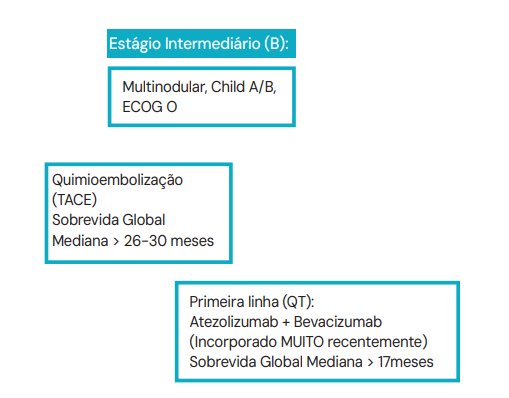
Estágio B (Intermediário)
Pacientes com múltiplos nódulos, mas sem invasão vascular, Child A/B.
- Conduta: Quimioembolização Transarterial (TACE).
- Mecanismo: Injeta-se quimioterápico diretamente na artéria que nutre o tumor e, em seguida, oclui-se o vaso (embolização). O tumor sofre por ação da droga e por isquemia.
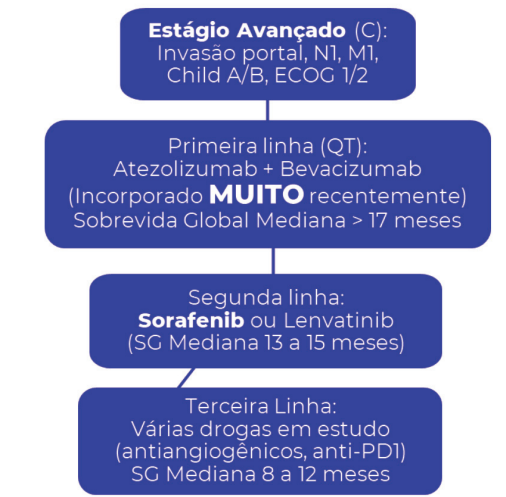
Estágio C (Avançado)
Pacientes com invasão da veia porta, metástases extra-hepáticas ou sintomas constitucionais (ECOG 1-2).
- Conduta: Terapia Sistêmica.
- Padrão Atual: Imunoterapia (Atezolizumab) associada a antiangiogênico (Bevacizumab). Essa combinação superou o antigo Sorafenibe, oferecendo sobrevida global mediana superior a 17 meses.
Estágio D (Terminal)
Pacientes com disfunção hepática grave (Child C) ou performance ruim (acamados).
- Conduta: Cuidados Paliativos (Best Supportive Care).


Tratamento do Carcinoma
O tratamento do CHC é ditado pelo estadiamento BCLC (Barcelona Clinic Liver Cancer), que estratifica os pacientes não apenas pelo tumor, mas pela reserva funcional hepática e performance status. A complexidade do manejo reside no fato de que não tratamos apenas um tumor, mas também uma doença hepática crônica subjacente (cirrose) que limita nossas opções.
Terapias Curativas (Estádios 0 e A)
O objetivo aqui é a cura completa, com sobrevida esperada superior a 5-10 anos.
A. Ressecção Cirúrgica (Hepatectomia)
É a primeira escolha para pacientes com função hepática preservada e tumor solitário. No entanto, é a opção mais restritiva devido aos critérios de segurança rigorosos.
- O Candidato Ideal: Deve ter Child A, MELD 8 e, crucialmente, ausência de Hipertensão Portal clinicamente significativa.
- Critério de Exclusão: A presença de varizes esofágicas ou esplenomegalia com plaquetopenia (< 100.000) geralmente contraindica a ressecção, pois o risco de descompensação (ascite, falência hepática) no pós-operatório é proibitivo.
- Margem e Remanescente: Busca-se margens livres com preservação de pelo menos 40-50% do parênquima hepático para evitar insuficiência hepática pós-hepatectomia.
B. Transplante Hepático
É a terapia “perfeita” teoricamente, pois remove o tumor e cura a cirrose.
- Critérios de Milão (O “Passaporte”):
- Nódulo único 5 cm.
- Ou até 3 nódulos, nenhum maior que 3 cm.
- Nota: Nódulos < 2 cm podem ser desconsiderados na contagem inicial em alguns protocolos.
- Priorização (MELD Especial): Para compensar o risco de dropout (tumor crescer e sair dos critérios enquanto espera), o paciente ganha pontos extras no MELD: inicia com 20, sobe para 24 em 3 meses e para 29 em 6 meses.
C. Ablação por Radiofrequência (RFA) ou Micro-ondas
Induz necrose tumoral térmica. É considerada curativa para lesões pequenas.
- Indicação: Nódulos < 3 cm, longe de grandes vasos (para evitar o heat sink effect – o sangue esfria a lesão e impede a ablação) e longe da via biliar principal.
- Posicionamento: É a escolha para Estádio 0 (Muito Precoce) ou para pacientes Estádio A não candidatos à cirurgia.
Terapias Locorregionais (Estádio B – Intermediário)
Para o paciente com doença multinodular, mas restrita ao fígado e com função preservada.
Quimioembolização Transarterial (TACE)
- Mecanismo: Cateterismo superseletivo da artéria hepática que nutre o tumor. Injeta-se quimioterápico + partículas embolizantes. O tumor sofre por isquemia (corta o suprimento) e citotoxicidade (droga local).
- Resultados: Aumenta a sobrevida mediana para > 26-30 meses.
- Contraindicações: Trombose de veia porta (pois o fluxo portal é o que mantém o fígado não tumoral vivo após a embolização arterial) e descompensação hepática (Child C).
Terapia Sistêmica (Estádio C – Avançado)
Reservada para doença extra-hepática ou invasão vascular macroscópica.
A Revolução da Imunoterapia
O padrão-ouro mudou recentemente.
- 1ª Linha:Atezolizumab (inibidor de checkpoint PD-L1) + Bevacizumab (anti-VEGF).
- Impacto: Sobrevida global mediana superior a 17 meses, superando o antigo padrão.
- 2ª Linha (ou se contraindicação à imunoterapia): Inibidores de tirosina quinase: Sorafenibe ou Lenvatinibe (Sobrevida de 12-15 meses).
- 3ª Linha: Outros inibidores multiquinase (Regorafenibe, Cabozantinibe) ou novas imunoterapias.
Radioterapia: O “Novo” Jogador
Historicamente evitada por medo de toxicidade, a radioterapia moderna ganhou espaço com tecnologias de precisão.
- SBRT (Stereotactic Body Radiation Therapy): Alta dose de radiação focal. Útil para lesões não passíveis de ablação ou TACE.
- Radioembolização (TARE): Similar à TACE, mas usa microesferas radioativas (Ítrio-90) em vez de quimioterapia. Tem crescido como opção para casos
Seja um MedCofer!
Quer alcançar a aprovação nas provas de residência médica? Então seja um MedCofer! Aqui te ajudaremos na busca da aprovação com conteúdos de qualidade e uma metodologia que já aprovou mais de 35 mil residentes no país! Por fim, acesse o nosso canal do youtube para ver o nosso material.